Structura atomică și moleculară
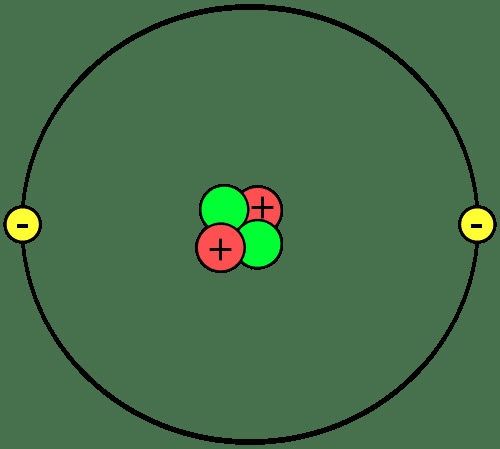
Blocurile de bază ale materiei sunt atomii, care se unesc pentru a forma molecule sau compuși. Este important să cunoaștem părțile unui atom, ce sunt ionii și izotopii și modul în care atomii se unesc.
Părți ale unui atom
Atomii sunt alcătuiți din trei componente:
- protoni - sarcină electrică pozitivă
- neutroni - fără sarcină electrică
- electroni - sarcină electrică negativă
Protonii și neutronii formează nucleul sau centrul fiecărui atom. Electronii orbitează nucleul. Deci, nucleul fiecărui atom are o sarcină netă pozitivă, în timp ce porțiunea exterioară a atomului are o sarcină negativă netă. În reacțiile chimice, atomii pierd, câștigă sau împărtășesc electroni. Nucleul nu participă la reacții chimice obișnuite, deși degradarea nucleară și reacțiile nucleare pot provoca schimbări în nucleul atomic.
Atomi, Ionii și izotopii
Numărul de protoni dintr-un atom determină ce element este. Fiecare element are câte una sau două litere
simbol care este utilizat pentru a-l identifica în formulele și reacțiile chimice. Simbolul pentru heliu este El. Un atom cu doi protoni este un atom de heliu indiferent de câți neutroni sau electroni are. Un atom poate avea același număr de protoni, neutroni și electroni sau numărul de neutroni și / sau electroni poate diferi de numărul de protoni.Atomii care poartă o sarcină electrică netă pozitivă sau negativă sunt ionii. De exemplu, dacă un atom de heliu pierde doi electroni, ar avea o sarcină netă de +2, care ar fi scrisă He2+.
Varierea numărului de neutroni dintr-un atom determină care izotop a unui element este. Atomii pot fi scrise cu simboluri nucleare pentru a identifica izotopul lor, în cazul în care numărul de nucleoni (protoni plus neutroni) este listat mai sus și în stânga simbolului unui element, cu numărul protonilor enumerați mai jos și în stânga simbol. De exemplu, trei izotopi ai hidrogenului sunt:
11H, 21H, 31H
Deoarece știți că numărul protonilor nu se schimbă niciodată pentru un atom al unui element, izotopii sunt mai des scrise folosind simbolul elementului și numărul de nucleoni. De exemplu, puteți scrie H-1, H-2 și H-3 pentru cei trei izotopi ai hidrogenului sau U-236 și U-238 pentru doi izotopi comuni ai uraniului.
Numărul atomic și greutatea atomică
numar atomic a unui atom identifică elementul și numărul său de protoni. greutate atomica este numărul protonilor plus numărul de neutroni dintr-un element (deoarece masa electronilor este atât de mică în comparație cu cea a protonilor și neutronilor, încât în esență nu contează). Greutatea atomică este uneori numită masă atomică sau numărul de masă atomică. Numărul atomic de heliu este de 2. Greutatea atomică a heliului este de 4. Rețineți că masa atomică a unui element din tabelul periodic nu este un număr întreg. De exemplu, masa atomică a heliului este dată ca 4.003 și nu 4. Acest lucru se datorează faptului că tabelul periodic reflectă abundența naturală a izotopilor unui element. În calculele chimice, utilizați masa atomică dată pe tabelul periodic, presupunând că un eșantion al unui element reflectă gama naturală de izotopi pentru acel element.
molecule
Atomii interacționează între ei, formând adesea legături chimice între ei. Când doi sau mai mulți atomi se leagă între ei, ei formează o moleculă. O moleculă poate fi simplă, cum ar fi H2, sau mai complexe, cum ar fi C6H12O6. Indiciile indică numărul fiecărui tip de atom într-o moleculă. Primul exemplu descrie o moleculă formată din doi atomi de hidrogen. Al doilea exemplu descrie o moleculă formată din 6 atomi de carbon, 12 atomi de hidrogen și 6 atomi de oxigen. În timp ce puteți scrie atomii în orice ordine, convenția este de a scrie mai întâi trecutul încărcat pozitiv al unei molecule, urmat de partea încărcată negativ a moleculei. Deci, clorura de sodiu este scrisă NaCl și nu ClNa.
Note și revizuire a tabelelor periodice

Tabelul periodic este un instrument important în chimie. Aceste note examinează tabelul periodic, modul în care este organizat și tendințele tabelelor periodice.
Invenția și organizarea tabelului periodic
În 1869, Dmitri Mendeleev a organizat elementele chimice într-un tabel periodic asemănător cu cel pe care îl folosim astăzi, cu excepția elementelor sale au fost ordonate în funcție de creșterea greutății atomice, în timp ce masa modernă este organizată prin creșterea atomică număr. Modul în care sunt organizate elementele face posibilă observarea tendințelor proprietăților elementelor și prezicerea comportamentului elementelor în reacțiile chimice.
Rândurile (se deplasează de la stânga la dreapta) sunt apelate perioadele. Elementele dintr-o perioadă împărtășesc același nivel energetic cel mai ridicat pentru un electron neexcitat. Există mai multe niveluri secundare pe nivel de energie pe măsură ce mărimea atomului crește, deci există mai multe elemente în perioade mai jos în tabel.
Coloanele (deplasarea de sus în jos) constituie baza elementului Grupuri. Elementele din grupuri împărtășesc același număr de electroni de valență sau de aranjare a carcasei electronilor exterioare, ceea ce oferă elementelor dintr-un grup mai multe proprietăți comune. Exemple de grupe de elemente sunt metale alcaline și gaze nobile.
Tabelele periodice Tendințe sau periodicitate
Organizarea tabelului periodic permite vizualizarea tendințelor proprietăților elementelor dintr-o privire. Tendințele importante se referă la o rază atomică, energie de ionizare, electronegativitate și afinitate de electroni.
-
Radius atomic
Raza atomică reflectă dimensiunea unui atom. Raza atomică scade deplasarea de la stânga la dreapta de-a lungul unei perioade și crește mișcarea de sus în jos jos un grup de elemente. Deși s-ar putea crede că atomii ar deveni pur și simplu mai mari pe măsură ce câștigă mai mulți electroni, electronii rămân într-o coajă, în timp ce numărul din ce în ce mai mare de protoni atrage cojile mai aproape de nucleu. Deplasându-se într-un grup, electronii se găsesc mai departe de nucleu în cochilii noi de energie, astfel încât dimensiunea totală a atomului crește. -
Energie de ionizare
Energia de ionizare este cantitatea de energie necesară pentru a îndepărta un electron dintr-un ion sau atom în stare gazoasă. Energie de ionizare crește mișcarea de la stânga la dreapta de-a lungul unei perioade și scade mișcarea de sus în jos jos un grup. -
electronegativitate
Electronegativitatea este o măsură a cât de ușor un atom formează o legătură chimică. Cu cât electronegativitatea este mai mare, cu atât este mai mare atracția pentru legarea unui electron. electronegativitate scade deplasarea în jos a unui grup de elemente. Elementele din partea stângă a tabelului periodic tind să fie electropozitive sau mai probabil să doneze un electron decât să accepte unul. -
Afinitatea electronilor
Afinitatea electronilor reflectă cât de ușor un atom va accepta un electron. Afinitatea electronilor variază în funcție de grupul de elemente. Gazele nobile au afinități electronice aproape de zero, deoarece au învelișuri de electroni. Halogenii au afinități mari de electroni, deoarece adăugarea unui electron dă unui atom o carcasă de electroni complet umplută.
Obligatii si legaturi chimice

Legături chimice sunt ușor de înțeles dacă țineți cont de următoarele proprietăți ale atomilor și electronilor:
- Atomii caută cea mai stabilă configurație.
- Regula Octet afirmă că atomii cu 8 electroni în orbitalul lor extern vor fi cei mai stabili.
- Atomii pot împărtăși, da, sau lua electroni ai altor atomi. Acestea sunt forme de legături chimice.
- Legăturile apar între electronii de valență ai atomilor, nu electronii interiori.
Tipuri de obligațiuni chimice
Cele două tipuri principale de legături chimice sunt legăturile ionice și covalente, dar ar trebui să fiți conștienți de mai multe forme de legătură:
-
Obligatii ionice
Legături ionice se formează când un atom ia un electron de la alt atom. Exemplu: NaCl este format dintr-o legătură ionică în care sodiul își donează electronul de valență clorului. Clorul este un halogen. Toți halogenii au 7 electroni de valență și mai au nevoie de unul pentru a obține un octet stabil. Sodiul este un metal alcalin. Toate metalele alcaline au 1 electron de valență, pe care le donează ușor pentru a forma o legătură. -
Legaturi covalente
Legaturi covalente se formează când atomii împart electroni. Într-adevăr, diferența principală este că electronii din legăturile ionice sunt mai strâns asociați cu un atomic nucleu sau altul, care electronii într-o legătură covalentă sunt la fel de probabil să orbiteze un nucleu ca alte. Dacă electronul este mai strâns asociat cu un atom decât cu celălalt, a legătura covalentă polară poate forma. Exemplu: Legături covalente se formează între hidrogen și oxigen în apă, H2O. -
Obligatie metalica
Când cei doi atomi sunt metale, se formează o legătură metalică. Diferența dintre un metal este că electronii ar putea fi orice atom de metal, nu doar doi atomi dintr-un compus. Exemplu: legăturile metalice sunt observate în eșantioane de metale elementare pure, precum aur sau aluminiu, sau aliaje, cum ar fi arama sau bronzul.
Este posibil să vă întrebați cum puteți spune dacă o legătură este ionică sau covalentă. Puteți privi amplasarea elementelor în tabelul periodic sau un tabel de element electronegativities pentru a prezice tipul de legătură care se va forma. Dacă valorile electronegativității sunt foarte diferite unele de altele, se va forma o legătură ionică. De obicei, cationul este un metal, iar anionul este un nemetal. Dacă elementele sunt ambele metale, așteptați-vă să se formeze o legătură metalică. Dacă valorile electronegativității sunt similare, așteptați-vă să se formeze o legătură covalentă. Legăturile dintre două nemetale sunt legături covalente. Legăturile covalente polare se formează între elementele care au diferențe intermediare între valorile electronegativității.
Cum se numesc compuși - Nomenclatură chimică
Pentru ca chimiștii și alți oameni de știință să poată comunica între ei, a fost convenit de către Uniunea Internațională de Chimie Pură și Aplicată sau IUPAC, un sistem de nomenclator sau denumire. Veți auzi substanțe chimice numite denumirile lor comune (de exemplu, sare, zahăr și bicarbonat de sodiu), dar în laborator ar folosi nume sistematice (de exemplu, clorură de sodiu, zaharoză și bicarbonat de sodiu). Iată o trecere în revistă a unor puncte cheie despre nomenclatură.
Denumirea compușilor binari
Compușii pot fi alcătuiți doar din două elemente (compuși binari) sau mai mult de două elemente. Anumite reguli se aplică la numirea compușilor binari:
- Dacă unul dintre elemente este un metal, acesta este numit mai întâi.
- Unele metale pot forma mai mult de un ion pozitiv. Este comun să se menționeze încărcarea pe ion folosind cifre romane. De exemplu, FeCl2 este clorura de fier (II).
- Dacă al doilea element este un nemetal, numele compusului este numele metalului urmat de o tulpină (prescurtare) a numelui nemetal, urmată de „ide”. De exemplu, NaCl este numit clorură de sodiu.
- Pentru compușii constând din două nemetale, elementul mai electropozitiv este denumit mai întâi. Tulpina celui de-al doilea element este numită, urmată de „ide”. Un exemplu este HCl, care este clorură de hidrogen.
Denumirea compușilor ionici
În plus față de regulile de denumire a compușilor binari, există și convenții de denumire suplimentare pentru compuși ionici:
- Unii anioni poliatomici conțin oxigen. Dacă un element formează doi oxianioni, cel cu mai puțin oxigen se termină în -ite în timp ce cel cu mai mult oxgen se termină în -ate. De exemplu:
NU2- este nitrit
NU3- este nitrat